Lo primero que tiene que hacer un microorganismo a la hora de su nutrición
es captar los nutrientes que necesite desde el medio exterior. Debido a que la
bicapapa lipídica actúa como barrera que impide el paso de la mayor parte de
las sustancias, esto significa que deben existir mecanismos específicos para
lograr la entrada de los nutrientes. Además, teniendo en cuenta que las
bacterias suelen vivir en medios diluidos, deben realizar un “trabajo” para
trasladar muchos de esos nutrientes en contra del gradiente de concentración.
Tradicionalmente se viene considerando tres métodos principales de
transporte de sustancias a través de la membrana:
|
transporte pasivo inespecífico (=
difusión simple);
| |
|
transporte pasivo específico (=
difusión facilitada);
| |
|
transporte activo.
|
Como veremos, los más
importantes en procariotas son los sistemas de transporte activo.
2.1 TRANSPORTE PASIVO INESPECÍFICO O DIFUSIÓN SIMPLE
Este transporte consiste en la difusión pasiva de ciertas sustancias
para las que la membrana es impermeable, debido a la diferencia de concentración
(DC)
a ambos lados de dicha membrana (la sustancia tiene mayor concentración fuera
que dentro de la célula). Aparte de esta diferencia de concentración, en la
difusión pasiva influyen:
|
la constante de permeabilidad (P),
es decir, el grado de permeabilidad de la membrana a la sustancia en cuestión;
| |
|
el área o superficie total (A) a
través de la que se produce el transporte.
|
Las membranas citoplásmicas son impermeables en sí mismas a la mayor
parte de las moléculas. Sólo se da en el caso de O2, CO2,
NH3, agua y otras pequeñas sustancias polares no ionizadas.
La difusión simple se produce por el paso de estas sustancias a través
de poros inespecíficos de la membrana citoplásmica.
2.2 TRANSPORTE PASIVO ESPECÍFICO O DIFUSIÓN FACILITADA
Es un proceso que permite el paso de compuestos por difusión a través
de transportadores estereoespecíficos y (al igual que en el caso anterior)
sobre la base de un gradiente de concentración (en la dirección termodinámicamente
favorable).
El transportador suele ser una proteína integral de membrana (permeasa o facilitador), cuya
conformación determina un canal interior, y por el cual un determinado sustrato
puede alcanzar el interior, sin gasto de energía. Se piensa que cuando el
soluto se une a la parte de la permeasa que da al exterior, esta proteína sufre
un cambio conformacional que libera la molécula en el interior. Como al entrar
la molécula, enseguida entra en el metabolismo y desaparece como tal, esto
basta para mantener el gradiente de concentración que permite esta difusión.
La difusión facilitada exhibe propiedades similares a las de las reacciones
enzimáticas:
|
Especificidad de sustrato: cada
permeasa transporte un solo tipo de sustratos químicamente parecidos.
| |
|
Cinética de saturación de tipo
Michaelis-Menten, es decir, la velocidad de transporte aumenta con la
concentración de sustrato, hasta un valor límite (Vmax) por
encima del cual ulteriores aumentos del soluto no aumentan dicha velocidad
(debido a que todas las porinas disponibles están ya totalmente ocupadas):
|
Velocidad
de entrada: Vent = Vmáx
· [Sext] /Km
+ [Sext]
Velocidad
de salida: Vsal
= Vmáx · [Sint]
/Km + [Sint]
Aunque este sistema de transporte es muy común en eucariotas, es muy
raro encontrarlo en bacterias. La explicación evolutiva es que los procariotas
suelen vivir en ambientes con pocas concentraciones de nutrientes, y por lo
tanto no es frecuente que se den gradientes adecuados. Una de las pocas
excepciones la constituye el glicerol, que es transportado por difusión
facilitada en una amplia gama de bacterias, tanto Gram-positivas como
Gram-negativas. Conforme el glicerol entra, es rápidamente convertido a
glicerol-fosfato; por lo tanto, la concentración interna de glicerol como tal
es prácticamente nula, lo que facilita esta difusión incluso a bajas
concentraciones exteriores de esta sustancia. En Zymomonas
existe un facilitador de membrana que transporta glucosa.
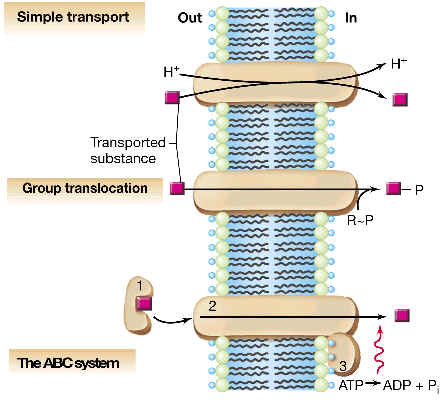
2.3 TRANSPORTE ACTIVO
Consiste en el transporte de sustancias en
contra de un gradiente de concentración, lo que requiere un gasto energético. En la mayor parte de
los casos este transporte activo (que supone un trabajo osmótico) se realiza
|
a
expensas de un gradiente de H+ (potencial electroquímico de
protones) previamente creado a ambos
lados de la membrana, por procesos de respiración y fotosíntesis;
| |
|
por
hidrólisis de ATP.
|
Los sistemas de transporte activo son los más abundantes entre las
bacterias, y se han seleccionado evolutivamente debido a que en sus medios
naturales la mayoría de los procariotas se encuentran de forma permanente o
transitoria con una baja concentración de nutrientes.
Los sistemas de transporte activo están basados en permeasas específicas
e inducibles. El modo en que se
acopla la energía metabólica con el transporte del soluto aún no está
dilucidado, pero en general se maneja la hipótesis de que las permeasas, una
vez captado el sustrato con gran afinidad, experimentan un cambio conformacional
dependiente de energía que les hace perder dicha afinidad, lo que supone la
liberación de la sustancia al interior celular.
Estudiaremos los siguientes tipos de
transporte activo:
|
transporte activo ligado a
simporte de protones;
| |
|
transporte
activo ligado a simporte de iones Na+
| |
|
transporte activo dirigido por ATP
| |
|
transporte
acoplado a translocación de grupos.
|
2.3.1 TRANSPORTE ACTIVO LIGADO A SIMPORTE DE PROTONES
Como se recordará, el simporte se puede definir como el transporte
simultáneo de dos sustratos en la misma dirección, por un mismo transportador
sencillo. En el caso del transporte activo ligado a simporte de protones, lo que
ocurre es que uno de los sustratos (H+) ha creado previamente un
gradiente de concentración, cuya disipación es aprovechada por el otro
sustrato para entrar con él. Este otro sustrato puede ser:
|
una molécula de carga negativa:
en este caso, su simporte ligado a protones tiende a disipar sólo el
gradiente de concentración. Ejemplos: transporte de iones fosfato, de
glutamato, etc.
| |
|
una molécula neutra: en este
caso, su simporte tiende a disipar no sólo el gradiente de concentración,
sino también el gradiente eléctrico. Ejemplo: en Escherichia
coli, la lactosa usa una ß-galactósido-permeasa, que es una de las
permeasas bacterianas más intensamente estudiadas.
|
Por
otro lado, ciertas moléculas catiónicas (iones K+, lisina), son
transportadas directamente a través de permeasas, en ausencia de simporte de
protones.
2.3.2 TRANSPORTE ACTIVO LIGADO A SIMPORTE DE IONES SODIO
Se puede considerar una versión modificada del anterior: algunas
sustancias no son transportadas activamente de forma directa por el potencial
electroquímico de protones, sino indirectamente, a través de un gradiente de
Na+ que a su vez se origina a expensas de dicha fuerza protón-motriz
(fpm).
El sustrato entra por una permeasa, junto con iones Na+, pero
a su vez este sodio se recicla por un sistema de antiporte, a expensas de la
disipación del potencial de protones.
Ejemplo: el azúcar melibiosa, en el caso de la enterobacteria E. coli.
Estos dos tipos de transporte activo
ligados a simporte quedan inhibidos si tratamos las células con algún agente ionóforo
(p. ej., el antibiótico valinomicina), que destruye el potencial electroquímico
de protones.
El transporte activo ligado a simporte de iones (H+, Na+)
resulta muy económico, ya que sólo se gasta un protón por cada molécula
transportada, mientras que por cada ATP sintetizado se suelen gastar 3 protones
que se disipan en las ATPasas. Las permeasas que realizan este transporte suelen
ser proteínas integrales de membrana provistas de unos 12 segmentos
transmembranosos en configuración de a-hélice.
2.3.3 TRANSPORTE ACTIVO DIRIGIDO POR ATP
El tipo paradigmático de este tipo de transporte se denomina de transportadores
ABC o ATPasas de tráfico, y
se conocen muchos ejemplos en eubacterias y arqueas. Vamos a describir el
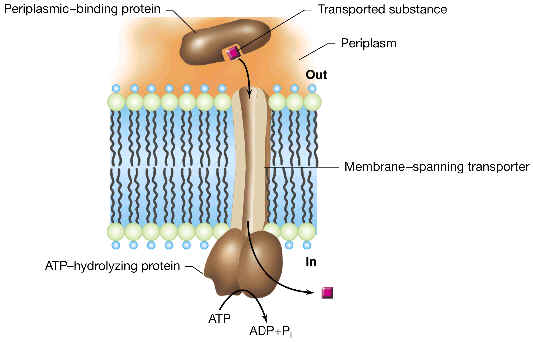
caso de un sistema ABC en enterobacterias (como E. coli). Se trata de un
sistema de varios componentes, en el que existen proteínas periplásmicas que
captan el sustrato con gran afinidad, y lo llevan hasta unas proteínas de
membrana, las cuales acoplan el paso de dicho sustrato hasta el citoplasma (sin
alteralo químicamente) con la hidrólisis de ATP.
La denominación de "transportadores ABC" se debe a que en todos ellos existe una o dos proteínas periféricas de membrana citoplásmica que poseen un dominio (de unos 200 aminoácidos) conservado evolutivamente, denominado "cassette de unión a ATP" (las iniciales de ATP-binding cassette generan la sigla "ABC"). Al parecer este dominio ABC conservado es muy antiguo, y parece que ya existía antes de la divergencia evolutiva entre procariotas y eucariotas. Existen muchos ejemplos de proteínas ABC, tanto en procariotas como eucariotas (de hecho constituyen la mayor familia de proteínas filogenéticamente relacionadas de todo el mundo vivo). Los primeros ejemplos de esta gran familia estaban implicados en transportar sustancias a uno u otro lado de la membrana. En otro tema veremos ejemplos de transportadores ABC que funcionan "al revés" de los de este tema: son "exportadores" de proteínas recién sintetizadas que deben insertarse en las envueltas bacterianas o ser excretadas al medio. Pero se ha descubierto que la gran familia de proteínas ABC está implicada en otros procesos (regulación genética, reparación de ADN, patogenicidad, etc).
Elementos
de este tipo de sistema:
|
Porinas u otras proteínas de
membrana externa para lograr la difusión del sustrato desde el medio hasta
el espacio periplásmico.
| |
|
Proteína(s) solubles de espacio
periplásmico que se unen al sustrato con gran afinidad.
| |
|
Un
heterodímero formado por dos proteínas integrales de membrana (cada una de
ellas posee 5 o 6 trechos en a-hélice
que atraviesan la membrana citoplásmica), que son la permeasa propiamente
dicha del sistema (el canal por donde pasa el sustrato).
| |
|
Dos proteínas periféricas de
membrana citoplásmica, adosadas al lado citoplásmico, que incluyen el módulo
conservado ABC que acopla la hidrólisis de ATP con el transporte
unidireccional del sustrato a través de la membrana.
|
Modelo
del mecanismo de este sistema:
1.
El sustrato exógeno normalmente entra al periplasma a través de algún
canal inespecífico o porina de membrana externa (por ejemplo, en
enterobacterias se pueden usar las porinas generales conocidas como OmpF y
OmpC).
2.
La proteína periplásmica específica, antes de su unión al sustrato
tiene una determinada configuración (denominada “abierta”), con dos grandes
lóbulos globulares unidos formando un ángulo (la forma recuerda una almeja a
medio abrir). Cuando el sustrato pasa al periplasma, la correspondiente proteína
de unión periplásmica se une a él con gran afinidad (0.1-1 mM),
y al unirse cambia de conformación. En esta configuración, llamada
“cerrada”, el sustrato se encuentra “enterrado” entre los dos lóbulos
de la proteína (“almeja cerrada”).
3.
Mientras tanto, el dímero de proteínas integrales de membrana (antes de
la unión con la proteína periplásmica) se encuentra en un estado energizado
pero incapaz de transportar sustrato. En esta situación, puede unirse (por la
parte que da al periplasma) al complejo formado por la proteína periplásmica
(en configuración “cerrada”) ligada al sustrato. Al hacer esto, el heterodímero
de membrana cambia de conformación, de modo que ahora muestra mayor afinidad
hacia la proteína periplásmica y se abre su canal para dejar entrar el
sustrato.
4.
Entonces, el complejo de membrana alcanza su estado de mínima energía,
y con ello descarga el sustrato en el citoplasma y se logra la separación de la
proteína periplásmica (que vuelve a su configuración “abierta”).
5.
Finalmente, la hidrólisis de ATP catalizada por las proteínas periféricas
ABC (adosadas a la membrana y asociadas a las proteínas integrales) suministra
la energía para que el heterodímero de membrana vuelva a su estado energizado
inicial, preparado así para otro ciclo de transporte.
El
sistema ABC de bacterias Gram-negativas, queda puesto de manifiesto cuando lo
impedimos por algún procedimiento que altere o elimine la membrana externa
(conversión a esferoplastos): Por ejemplo: tratemos E.
coli con el quelante EDTA en una solución tamponada isotónica (con un 20%
de sacarosa). Centrifugamos y el sedimento de células lo resuspendemos en una
solución de MgCl2 en frío (0ºC). El resultado es que las proteínas
del periplasma escapan al medio externo. Esto es un caso de tratamiento por choque
osmótico que origina pérdida de contenidos del periplasma. Se comprueba
que ciertos sistemas de transporte quedan inutilizados, debido a que requieren
para su funcionamiento, amén de proteínas
de membrana citoplásmica, otras específicas del espacio periplásmico. Por
contra, este sistema no se ve afectado por los agentes ionóforos. Por esta razón,
a este sistema en Gram-negativas se le ha llamado durante mucho tiempo “transporte
activo sensible a choque osmótico”.
Los sistemas ABC de bacterias
Gram-positivas están menos estudiados, pero en general se parecen a los de
Gram-negativas, salvo que carecen del transportador libre periplásmico. En su
lugar existe una proteína con funciones equivalentes (captar el nutriente del
exterior), pero que está anclada al lado externo de la membrana citoplásmica,
cerca del heterodímero integral de membrana (la unión es mediante su cisteína
N-terminal, que se une a un fosfolípido).
Existen muchos ejemplos de transportadores procarióticos de tipo ABC, y
cada uno de ellos está especializado en transportar un sustrato específico o
varios sustratos parecidos. Ejemplo de sustratos transportados de esta forma:
|
Monosacáridos
como arabinosa, galactosa, maltosa, ribosa, xilosa, etc.
| |
|
Oligosacáridos
| |
|
Iones
orgánicos e inorgánicos
| |
|
Aminoácidos
como histidina, glicina, leucina, etc.
| |
|
Oligopéptidos
| |
|
Algunas vitaminas y metales.
| |
|
Sideróforos
con hierro
|
2.3.4 TRANSPORTE ACOPLADO A TRANSLOCACION DE GRUPOS
Es un sistema de transporte que acopla la entrada del sustrato con su
modificación química por unión covalente con un grupo químico. Estrictamente
hablando, no es un transporte activo, porque no funciona en contra de un
gradiente de concentración, pero se considera de hecho como activo, ya que la
concentración del sustrato modificado
dentro de la célula supera con creces a la del sustrato sin
modificar en el exterior.
Este sistema supone un ahorro de energía metabólica: aunque en el
transporte se gasta un enlace rico en energía, el sustrato queda modificado en
su paso a través de la membrana en la forma que la bacteria emplea como primer
intermediario de su ruta metabólica. Es decir, con un solo proceso se cumplen
dos funciones distintas: transporte y preparación química para la ruta, que de
todas formas habría que realizar. No es de extrañar que este tipo de
transporte haya sido seleccionado frecuentemente en la evolución bacteriana, y
que hoy lo encontremos en muchos procariotas, especialmente en bacterias
anaerobias o aerobias facultativas que recurren a fermentaciones (recordar que
las fermentaciones tienen un rendimiento energético menor que los procesos
respiratorios; por lo tanto, es “lógico” que se seleccionen mecanismos
ahorradores como el descrito).
El caso mejor estudiado de esta clase de transporte lo constituye el
llamado sistema de
fosfotransferasa de azúcares (según las casi inevitables
iniciales inglesas: PTS).
En E. coli el sistema PTS
permite el transporte de glucosa, manosa, fructosa y los polioles sorbitol y
manitol.
Consta de varios componentes que funcionan como una cadena de
transportadores del grupo fosfato de alta energía del fosfoenolpirúvico (PEP)
hasta el azúcar a transportar en cuestión.
|
Las dos primeras proteínas son
inespecíficas respecto del azúcar (son comunes
a los diversos sustratos a transportar), tienen localización
citoplásmica y su síntesis es
constitutiva. Se conocen como
| |||||||
|
El otro componente, llamado Enzima
II (EII) es específico de cada azúcar,
y su síntesis es inducible por el
correspondiente sustrato: Suele estar compuesto por tres subunidades o
dominios:
|
Veamos cómo funciona el
sistema:
1.
Por un lado, el azúcar se une al enzima EIIC específico, pero éste por
sí mismo no puede liberar al azúcar sin modificar en el interior celular.
2.
Mientras tanto, la EI cataliza (en presencia de Mg++) la
transferencia del fosfato de alta energía del PEP a la HPr.
3.
La HPr fosforilada (HPr-P) transfiere el fosfato al enzima IIA específico
del azúcar [p. ej., la glucosa (EIIAGlc ) o el manitol (EIIAMtl)].
4.
La EIIA-P rápidamente, y en presencia de Mg++, transfiere el
fosfato a la enzima-IIB específica con la que se asocia (p. ej., EIIBGlc),
que a su vez fosforila el azúcar (en el caso de la glucosa convirtiéndola en
glucosa-6-P): en este momento la EIIC pierde su afinidad por el azúcar
modificado, que de esta forma entra en el citoplasma, preparado ya para actuar
como sustrato de la primera reacción del catabolismo de este azúcar.
Otros ejemplos de transporte acoplado
a translocación de grupos:
|
Entrada de ácidos grasos mediante
un sistema de transferencia de Coenzima A, que los transforma en acil-CoA.
| |
|
Entrada
de purinas y pirimidinas, mediante un sistema de fosforribosil-transferasas:
|
purina o pirimidina (exterior) + PRPP à
NMP (interior) + P
(PRPP = fosforribosil-pirofosfato)
(NMP = nucleósido monofosfato)
En bacterias es frecuente encontrar varios sistemas de transporte para un
mismo nutriente (p. ej., Escherichia coli
posee cinco sistemas para transportar la galactosa y tres sistemas para algunos
de los aminoácidos. Los diversos sistemas se diferencian en cuanto a su
requerimiento energético, su afinidad, su regulación, etc. Lógicamente, la
evolución ha debido seleccionar esta redundancia de sistemas de transporte con
objeto de permitir que el microorganismo sobreviva bajo diversas circunstancias
ambientales.
2.4 TRANSPORTE DE HIERRO
El hierro es un cofactor de muchas enzimas y citocromos, por lo que las
bacterias necesitan captarlo. La captación de hierro se complica porque el ión
férrico (Fe3+) es muy insoluble. Además, las bacterias que viven
dentro de animales superiores tienen un problema: en los fluidos y tejidos de
sus patrones el hierro libre es muy poco abundante (el hierro suele estar
acomplejado con proteínas), por lo que se vuelve vital aprovisionarse con este
elemento de alguna manera.
Muchas bacterias secretan unas moléculas de bajo peso molecular llamadas
en general sideróforos,
que son capaces de formar quelatos (complejos) con el hierro férrico. Por
ejemplo, Escherichia coli secreta un sideróforo llamado enterobactina.
Cuando la enterobactina se une al hierro, forma un complejo octaédrico, que
luego se engarza con un receptor específico de la membrana externa, tras lo que
el hierro se libera al espacio periplásmico, desde donde entra al citoplasma
por medio de una proteína de unión periplásmica acoplada a un sistema ABC
similar al visto más arriba.
No hay comentarios:
Publicar un comentario